- PURINES ET PYRIMIDINES (MÉTABOLISME DES)
- PURINES ET PYRIMIDINES (MÉTABOLISME DES)En plus de leur rôle fondamental dans la constitution des acides nucléiques, certaines bases azotées hétérocycliques jalonnent les étapes de tout le métabolisme cellulaire, sous forme, d’une part, de nucléotides riches en énergie (ATP, GTP), d’autre part, de facteurs de croissance, ou vitamines. Les bases puriques et pyrimidiques appartiennent à deux séries de dérivés hétérocycliques et se rattachent aux structures fondamentales représentées dans la figure 1 de l’article acides NUCLÉIQUES. Parmi les bases pyrimidiques, la cytosine et l’uracile sont des constituants des acides ribonucléiques (ARN), la cytosine et la thymine des constituants des acides désoxyribonucléiques (ADN). Les deux bases puriques, l’adénine et la guanine, sont des composants des acides ribo- et désoxyribonucléiques. Il existe d’autres bases légèrement différentes, comme la méthylcytosine et la méthylguanine, qui proviennent respectivement de la cytosine et de la guanine. Leur proportion est relativement faible dans l’organisme par rapport aux cinq bases principales. On a pu aborder l’étude de la biosynthèse et de la dégradation des purines et des pyrimidines chez les espèces supérieures en administrant des précurseurs radioactifs à des animaux.1. Les purinesBiosynthèseLe schéma général de la biosynthèse des purines est essentiellement le même chez tous les organismes. L’origine des différents atomes du cycle purique a été établie, et la figure 1 montre que les précurseurs sont des molécules très simples (gaz carbonique, acide formique) et des acides aminés (glycine, glutamine, acide aspartique).En fait, la biosynthèse des purines est le résultat d’un grand nombre d’étapes qui aboutissent à la formation directe de nucléotides puriques, en l’occurrence l’acide inosinique, à partir d’éléments plus simples: le ribose 5-phosphate, des acides aminés (glutamine, glycine, acide aspartique), une source d’énergie (ATP) et l’intervention d’acide folique et de magnésium. Le cycle purique s’établit progressivement sur un squelette pentose phosphorylé par adjonction d’acides aminés; il exige plusieurs molécules d’ATP et implique dix étapes enzymatiques différentes (fig. 2 a), dont la première consiste enla synthèse de phosphoribosyl 1-pyrophosphate à partir du ribose 5-phosphate, et la dernière en la synthèse d’acide inosinique.La formation d’acide adénylique s’effectue à partir de l’acide inosinique grâce à l’acide aspartique et au guanosine triphosphate (GTP). Celle de l’acide guanylique passe également par l’intermédiaire de l’acide inosinique. Celui-ci est d’abord transformé en acide xanthylique.Il existe de surcroît deux voies de récupération qui aboutissent à la synthèse de nucléotides puriques par la réutilisation des purines provenant de la dégradation des acides nucléiques. Ce processus affecte chez l’homme 90 p. 100 des purines libres; le déficit en guanine-phosphoribosyl-transférase réalise la maladie de Lesch-Nyhan.Première voie: les purines libres peuvent réagir avec le phosphoribosyl pyrophosphate pour aboutir directement à la synthèse des nucléotides (blocage de la réaction sur la guanine en cas de Lesch-Nyhan).Deuxième voie: les bases puriques peuvent conduire, par adjonction de ribose, à la formation de nucléosides puriques, lesquels sont ensuite phosphorylés en nucléotides.La conversion d’une purine à l’autre est également possible (fig. 2 b).DégradationChez les Mammifères supérieurs, l’acide urique est le principal produit de la dégradation des purines. Ainsi, le noyau purique n’est pas complètement dégradé. En revanche, chez certains Mammifères, comme le chien, l’acide urique est transformé en allantoïne sous l’action de l’uricase, enzyme absente chez les Primates. Chez les animaux autres que les Mammifères, la dégradation des purines aboutit à la formation d’urée, puis d’ammoniac et de gaz carbonique.Chez l’homme, l’acide adénylique et l’adénosine sont désaminés, perdent leur ribose, le phosphoryle (cas de l’acide adénylique), et sont ainsi transformés en hypoxanthine, puis en xanthine, enfin en acide urique par la xanthine-oxydase (fig. 3). Quant à la guanine, elle est convertie en xanthine, puis en acide urique.L’accumulation d’acide urique dans le plasma, dans le rein et dans les cartilages est cause d’une maladie: la goutte, caractérisée par des accès d’inflammation articulaire. Cette maladie héréditaire est due à la déficience d’une enzyme: l’hypoxanthine-guanine-phosphoribosyl-transférase (HGPT). Cette enzyme est nécessaire à la reconstitution, à partir de l’hypoxanthine et de la xanthine (par l’intermédiaire de la guanine), des acides inosinique et guanylique, nucléotides qui exercent un effet rétro-inhibiteur sur l’amido-transférase (cf. infra : Régulation du métabolisme des purines ).Certains cas de goutte sont, semble-t-il, la conséquence soit d’un mécanisme anormal de contrôle de la régulation des synthèses et des dégradations des purines, soit d’un traitement médical: ainsi, l’emploi des agents cytolytiques dans le traitement du cancer conduit à une concentration très élevée d’acide urique; dans ces conditions, il est nécessaire de donner aux malades des diurétiques pour faciliter son élimination [cf. DIURÈSE ET DIURÉTIQUES].Une autre maladie héréditaire, assez rare, la xanthinurie , se caractérise par un déficit des tissus en xanthine-oxydase, enzyme qui transforme la xanthine en acide urique. Cette maladie s’accompagne de dépôts cristallins de xanthine et d’hypoxanthine dans les muscles, et se traduit par une myopathie grave [cf. MUSCLES].Dans le traitement de la goutte, on utilise un médicament, l’allopurinol, qui inhibe la xanthine-oxydase et diminue la concentration d’acide urique. Chez certains malades, ce traitement a provoqué une lithiase xanthique, analogue à celle qui est observée dans le cas de la xanthinurie héréditaire.Régulation du métabolisme des purinesLa synthèse des purines, comme celle des pyrimidines, est sous le contrôle des produits terminaux. Les mécanismes de régulation ont pour résultat d’empêcher le gaspillage de synthèses inutiles.La complexité des schémas de synthèse et de dégradation, l’existence de voies « de secours » rendent difficile l’étude de la régulation. Certaines étapes de la biosynthèse sont soumises à des effets activateurs ou inhibiteurs de type allostérique, qui ne sont pas tous parfaitement connus. En outre, le type et la spécificité des contrôles varient selon les espèces. On citera néanmoins quelques exemples bien étudiés:– La synthèse de 5-phosphoribosyl 1-pyrophosphate (PRPP) exige de l’ATP (fig. 2 a, réaction 1). Elle est inhibée par l’ADP. Lorsque le niveau d’ATP est faible, la réaction ne s’effectue pas et la synthèse des nucléotides puriques est diminuée.– L’amido-transférase, enzyme responsable de la biosynthèse de la 5-phosphoribosylamine (fig. 2 a, réaction 2), est réprimée par de nombreux nucléotides puriques comme l’ATP, le GTP, le GDP, ainsi que par l’acide inosinique. Il s’agit d’une inhibition compétitive vis-à-vis du PRPP. Selon certains auteurs, l’enzyme possède plusieurs sites, dont un responsable de l’activité catalytique et un ou plusieurs responsables de l’activité régulatrice.– Les interconversions entre purines sont aussi soumises à la régulation (fig. 2 b). Le guanosine 5 -phosphate (GMP) inhibe la transformation de l’inosine 5 -phosphate (IMP) en xanthine 5 -phosphate (XMP). Il en est de même des purines mononucléotides-pyrophosphorylases, enzymes responsables de la réaction suivante:
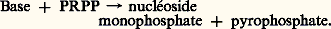 Les nucléoside-monophosphates, comme le GMP, inhibent ces enzymes.2. Les pyrimidinesBiosynthèseCe qui distingue fondamentalement la voie métabolique conduisant à la formation des nucléotides puriques de celle conduisant à la formation des nucléotides pyrimidiques est le moment de la formation du lien glycosidique entre la base et le sucre. Dans le cas des purines, ce lien se forme dans les premières étapes et le noyau purique est construit ensuite, alors que, dans le cas des pyrimidines, le noyau pyrimidique est synthétisé avant son attachement au ribose 5-phosphate (fig. 4).L’étape intermédiaire clé est la formation d’acide orotique, contenant le noyau pyrimidique, à partir du carbamyl-phosphate et de l’acide aspartique (fig. 4, réactions 1, 2, 3). Certains micro-organismes sont incapables de synthétiser l’acide orotique; dans ce cas, celui-ci est un facteur de croissance nécessaire à la biosynthèse de l’ADN et de l’ARN.Dans une deuxième étape, le ribose 5-phosphate est lié à l’acide orotique pour former l’orotidine 5 -phosphate, qui est ensuite décarboxylé en acide uridylique (uridine 5 -phosphate). L’acide cytidylique se forme à partir de l’acide uridylique par adjonction d’un groupement aminé provenant de la glutamine. L’acide thymidylique provient également de l’acide uridylique (cf. chap. 3). Une autre voie de synthèse de l’acide thymidylique est possible par l’intermédiaire de la thymidine (thymine liée au désoxyribose), qui est ensuite phosphorylée par la thymidine-kinase en présence d’ATP (fig. 4, réaction 8). Au cours de l’infection des cellules par un virus, cette voie semble prévaloir, et l’on observe très souvent dans ces cellules une augmentation très importante de la thymidine-kinase. Celle-ci peut utiliser un substrat « frauduleux » ressemblant à la thymidine, comme le 5-iodo-uracile désoxyriboside, et conduire à la synthèse d’un acide nucléique viral aberrant. Un tel analogue de structure s’est révélé fort actif dans le traitement des maladies à virus, comme la kératite herpétique.Dans le foie, des nucléoside-phosphorylases catalysent la formation des nucléotides pyrimidiques à partir de la base et du ribose phosphate.L’acidurie orotique est une maladie génétique due à un mauvais fonctionnement du métabolisme des pyrimidines; elle s’accompagne d’une excrétion importante d’acide orotique. Cette excrétion est abolie par administration d’uridine ou de cytidine. On a là la preuve d’un type d’inhibition régulatrice des mécanismes biosynthétiques, car ces nucléosides semblent inhiber les premières étapes de la biosynthèse de l’acide orotique (fig. 4), comme on le verra plus loin (Régulation du métabolisme des pyrimidines ). La cause de cette maladie serait attribuable à l’activité diminuée des deux enzymes, l’orotidine 5 -P-pyrophosphorylase et l’orotidine 5 -P-décarboxylase, mais ceci reste une hypothèse de travail.DégradationLa cytosine et la méthylcytosine sont désaminées respectivement en uracile et en thymine. Ces deux bases sont finalement hydrolysées en 廓-alanine et en 廓-amino-isobutyrate, qui peuvent être réutilisées dans le métabolisme des lipides et dans le cycle de Krebs (fig. 5).Régulation du métabolisme des pyrimidinesPlusieurs étapes de la biosynthèse et de la dégradation des pyrimidines sont soumises à des effets régulateurs. À titre d’exemples, on peut citer les réactions suivantes qui ont été particulièrement bien étudiées:– La première étape de la biosynthèse des pyrimidines est inhibée par un des derniers produits de cette synthèse (fig. 4). L’aspartate-carbamyl-transférase, qui permet la synthèse d’acide carbamyl-aspartique à partir du carbamyl-phosphate et de l’acide L-aspartique (fig. 4, réaction 1), est une des premières enzymes pour laquelle une rétro-inhibition de type allostérique ait été démontrée. Chaque molécule d’enzyme peut fixer d’une manière coopérative plusieurs molécules d’acide aspartique.Le cytidine 5 -triphosphate (CTP) inhibe spécifiquement l’enzyme. En revanche, l’ATP neutralise l’effet du CTP, et active l’enzyme. Selon la concentration relative de ces deux nucléotides, la réaction s’effectue ou non. En effet, selon G. Cohen, l’ATP et le CTP, en se liant à l’enzyme, changent la conformation de cette dernière, ce qui facilite ou inhibe la fixation du substrat. Aussi, lorsque la concentration des nucléotides puriques, tel l’ATP, augmente, la synthèse des pyrimidines est stimulée; par suite, la concentration des pyrimidines et des purines est maintenue constante. L’inhibition par le CTP est du type inhibition allostérique [cf. BIOLOGIE MOLÉCULAIRE]. On a en effet pu montrer que l’aspartate-carbamyl-transférase comporte deux fractions: l’une responsable de l’activité catalytique, l’autre de l’activité régulatrice. L’ATP et le CTP ont la propriété de se lier à l’enzyme sur la sous-unité régulatrice.– La dihydro-orotate-déshydrogénase intervient dans la deuxième étape de la biosynthèse des pyrimidines (fig. 4, réaction 3). Dans certaines cellules des organismes supérieurs, on a démontré qu’elle est inhibée par les nucléotides puriques et pyrimidiques.– La transformation du cytidine 5 -diphosphate en 2 -désoxycytidine 5 -diphosphate sous l’effet d’une réductase (fig. 4) est soumise à une régulation par l’ATP. Celui-ci stimule la réaction.En somme, la régulation des purines et des pyrimidines est un mécanisme physiologique général qui permet d’obtenir en quantité convenable des substrats nécessaires à la biosynthèse de l’ADN et de l’ARN.3. Biosynthèse des acides nucléiques macromoléculairesLes enzymes de polymérisation des acides ribonucléiques (ARN-polymérase) et celles des acides désoxyribonucléiques (ADN-polymérase) exigent comme substrat des nucléoside 5 -triphosphates dans le premier cas, des désoxyribonucléoside 5 -triphosphates dans le second. Les kinases sont les enzymes responsables de la phosphorylation des nucléosides en nucléoside mono-, di- et triphosphates; ces réactions ont besoin d’ATP comme source de groupements phosphoryles.Il existe une interconversion très importante des nucléotides pyrimidiques. Des réductases transforment des nucléoside 5 -phosphates en désoxyribonucléoside 5 -phosphates pour la biosynthèse de l’ADN. Comme exemple, on peut citer la biosynthèse d’acide thymidylique à partir d’acide uridylique: uridine 5 -monophosphate 1désoxyuridine 5 -monophosphate 2thymidine 5 -monophosphate 3thymidine 5 -diphosphate 4thymidine 5 -triphosphateADN (fig. 4). La réaction (1) transforme le ribose en désoxyribose; la réaction (2) méthyle l’uracile pour le transformer en thymine; les réactions (3) et (4) font intervenir des kinases pour aboutir à la synthèse de thymidine 5 -triphosphate qui sert de substrat à l’ADN-polymérase.D’autres réductases interviennent au niveau des nucléosides-diphosphates qui sont alors phosphorylés en triphosphates selon les étapes suivantes: cytidine 5 -diphosphate 1désoxycytidine 5 -diphosphate 2désoxycytidine 5 -triphosphateADN. Selon les espèces, telles ou telles voies métaboliques prédominent.4. Nucléotides coenzymesCertains nucléotides jouent un rôle métabolique important. De très nombreuses réactions métaboliques exigent l’acide adénylique, ou l’acide guanylique, ou encore leurs dérivés triphosphorylés (ATP, GTP), parfois d’autres dérivés plus complexes comme l’uridine diphosphoglucose, qui joue un rôle essentiel dans le métabolisme des sucres [cf. GLUCIDES]. L’adénosine 3 , 5 -monophosphate (AMP cyclique) semble jouer un rôle universel dans la régulation des processus enzymatiques [cf. HORMONES].Certaines coenzymes sont formées par l’association des nucléotides adényliques à d’autres constituants: tels que la nicotinamide (vitamine PP) pour la coenzyme I ou NAD (nicotinamide adénine dinucléotide), la riboflavine (vitamine B2) pour les coenzymes FMN et FAD (flavine mononucléotide et flavine adénine dinucléotide), l’acide panthoténique pour la coenzyme A [cf. OXYDORÉDUCTIONS BIOLOGIQUES]. Ces substances, associées à l’acide adénylique, interviennent dans de nombreuses réactions du métabolisme intermédiaire. Ce sont des facteurs de croissance pour de multiples espèces qui, ne pouvant les synthétiser, doivent les trouver dans leur alimentation.
Les nucléoside-monophosphates, comme le GMP, inhibent ces enzymes.2. Les pyrimidinesBiosynthèseCe qui distingue fondamentalement la voie métabolique conduisant à la formation des nucléotides puriques de celle conduisant à la formation des nucléotides pyrimidiques est le moment de la formation du lien glycosidique entre la base et le sucre. Dans le cas des purines, ce lien se forme dans les premières étapes et le noyau purique est construit ensuite, alors que, dans le cas des pyrimidines, le noyau pyrimidique est synthétisé avant son attachement au ribose 5-phosphate (fig. 4).L’étape intermédiaire clé est la formation d’acide orotique, contenant le noyau pyrimidique, à partir du carbamyl-phosphate et de l’acide aspartique (fig. 4, réactions 1, 2, 3). Certains micro-organismes sont incapables de synthétiser l’acide orotique; dans ce cas, celui-ci est un facteur de croissance nécessaire à la biosynthèse de l’ADN et de l’ARN.Dans une deuxième étape, le ribose 5-phosphate est lié à l’acide orotique pour former l’orotidine 5 -phosphate, qui est ensuite décarboxylé en acide uridylique (uridine 5 -phosphate). L’acide cytidylique se forme à partir de l’acide uridylique par adjonction d’un groupement aminé provenant de la glutamine. L’acide thymidylique provient également de l’acide uridylique (cf. chap. 3). Une autre voie de synthèse de l’acide thymidylique est possible par l’intermédiaire de la thymidine (thymine liée au désoxyribose), qui est ensuite phosphorylée par la thymidine-kinase en présence d’ATP (fig. 4, réaction 8). Au cours de l’infection des cellules par un virus, cette voie semble prévaloir, et l’on observe très souvent dans ces cellules une augmentation très importante de la thymidine-kinase. Celle-ci peut utiliser un substrat « frauduleux » ressemblant à la thymidine, comme le 5-iodo-uracile désoxyriboside, et conduire à la synthèse d’un acide nucléique viral aberrant. Un tel analogue de structure s’est révélé fort actif dans le traitement des maladies à virus, comme la kératite herpétique.Dans le foie, des nucléoside-phosphorylases catalysent la formation des nucléotides pyrimidiques à partir de la base et du ribose phosphate.L’acidurie orotique est une maladie génétique due à un mauvais fonctionnement du métabolisme des pyrimidines; elle s’accompagne d’une excrétion importante d’acide orotique. Cette excrétion est abolie par administration d’uridine ou de cytidine. On a là la preuve d’un type d’inhibition régulatrice des mécanismes biosynthétiques, car ces nucléosides semblent inhiber les premières étapes de la biosynthèse de l’acide orotique (fig. 4), comme on le verra plus loin (Régulation du métabolisme des pyrimidines ). La cause de cette maladie serait attribuable à l’activité diminuée des deux enzymes, l’orotidine 5 -P-pyrophosphorylase et l’orotidine 5 -P-décarboxylase, mais ceci reste une hypothèse de travail.DégradationLa cytosine et la méthylcytosine sont désaminées respectivement en uracile et en thymine. Ces deux bases sont finalement hydrolysées en 廓-alanine et en 廓-amino-isobutyrate, qui peuvent être réutilisées dans le métabolisme des lipides et dans le cycle de Krebs (fig. 5).Régulation du métabolisme des pyrimidinesPlusieurs étapes de la biosynthèse et de la dégradation des pyrimidines sont soumises à des effets régulateurs. À titre d’exemples, on peut citer les réactions suivantes qui ont été particulièrement bien étudiées:– La première étape de la biosynthèse des pyrimidines est inhibée par un des derniers produits de cette synthèse (fig. 4). L’aspartate-carbamyl-transférase, qui permet la synthèse d’acide carbamyl-aspartique à partir du carbamyl-phosphate et de l’acide L-aspartique (fig. 4, réaction 1), est une des premières enzymes pour laquelle une rétro-inhibition de type allostérique ait été démontrée. Chaque molécule d’enzyme peut fixer d’une manière coopérative plusieurs molécules d’acide aspartique.Le cytidine 5 -triphosphate (CTP) inhibe spécifiquement l’enzyme. En revanche, l’ATP neutralise l’effet du CTP, et active l’enzyme. Selon la concentration relative de ces deux nucléotides, la réaction s’effectue ou non. En effet, selon G. Cohen, l’ATP et le CTP, en se liant à l’enzyme, changent la conformation de cette dernière, ce qui facilite ou inhibe la fixation du substrat. Aussi, lorsque la concentration des nucléotides puriques, tel l’ATP, augmente, la synthèse des pyrimidines est stimulée; par suite, la concentration des pyrimidines et des purines est maintenue constante. L’inhibition par le CTP est du type inhibition allostérique [cf. BIOLOGIE MOLÉCULAIRE]. On a en effet pu montrer que l’aspartate-carbamyl-transférase comporte deux fractions: l’une responsable de l’activité catalytique, l’autre de l’activité régulatrice. L’ATP et le CTP ont la propriété de se lier à l’enzyme sur la sous-unité régulatrice.– La dihydro-orotate-déshydrogénase intervient dans la deuxième étape de la biosynthèse des pyrimidines (fig. 4, réaction 3). Dans certaines cellules des organismes supérieurs, on a démontré qu’elle est inhibée par les nucléotides puriques et pyrimidiques.– La transformation du cytidine 5 -diphosphate en 2 -désoxycytidine 5 -diphosphate sous l’effet d’une réductase (fig. 4) est soumise à une régulation par l’ATP. Celui-ci stimule la réaction.En somme, la régulation des purines et des pyrimidines est un mécanisme physiologique général qui permet d’obtenir en quantité convenable des substrats nécessaires à la biosynthèse de l’ADN et de l’ARN.3. Biosynthèse des acides nucléiques macromoléculairesLes enzymes de polymérisation des acides ribonucléiques (ARN-polymérase) et celles des acides désoxyribonucléiques (ADN-polymérase) exigent comme substrat des nucléoside 5 -triphosphates dans le premier cas, des désoxyribonucléoside 5 -triphosphates dans le second. Les kinases sont les enzymes responsables de la phosphorylation des nucléosides en nucléoside mono-, di- et triphosphates; ces réactions ont besoin d’ATP comme source de groupements phosphoryles.Il existe une interconversion très importante des nucléotides pyrimidiques. Des réductases transforment des nucléoside 5 -phosphates en désoxyribonucléoside 5 -phosphates pour la biosynthèse de l’ADN. Comme exemple, on peut citer la biosynthèse d’acide thymidylique à partir d’acide uridylique: uridine 5 -monophosphate 1désoxyuridine 5 -monophosphate 2thymidine 5 -monophosphate 3thymidine 5 -diphosphate 4thymidine 5 -triphosphateADN (fig. 4). La réaction (1) transforme le ribose en désoxyribose; la réaction (2) méthyle l’uracile pour le transformer en thymine; les réactions (3) et (4) font intervenir des kinases pour aboutir à la synthèse de thymidine 5 -triphosphate qui sert de substrat à l’ADN-polymérase.D’autres réductases interviennent au niveau des nucléosides-diphosphates qui sont alors phosphorylés en triphosphates selon les étapes suivantes: cytidine 5 -diphosphate 1désoxycytidine 5 -diphosphate 2désoxycytidine 5 -triphosphateADN. Selon les espèces, telles ou telles voies métaboliques prédominent.4. Nucléotides coenzymesCertains nucléotides jouent un rôle métabolique important. De très nombreuses réactions métaboliques exigent l’acide adénylique, ou l’acide guanylique, ou encore leurs dérivés triphosphorylés (ATP, GTP), parfois d’autres dérivés plus complexes comme l’uridine diphosphoglucose, qui joue un rôle essentiel dans le métabolisme des sucres [cf. GLUCIDES]. L’adénosine 3 , 5 -monophosphate (AMP cyclique) semble jouer un rôle universel dans la régulation des processus enzymatiques [cf. HORMONES].Certaines coenzymes sont formées par l’association des nucléotides adényliques à d’autres constituants: tels que la nicotinamide (vitamine PP) pour la coenzyme I ou NAD (nicotinamide adénine dinucléotide), la riboflavine (vitamine B2) pour les coenzymes FMN et FAD (flavine mononucléotide et flavine adénine dinucléotide), l’acide panthoténique pour la coenzyme A [cf. OXYDORÉDUCTIONS BIOLOGIQUES]. Ces substances, associées à l’acide adénylique, interviennent dans de nombreuses réactions du métabolisme intermédiaire. Ce sont des facteurs de croissance pour de multiples espèces qui, ne pouvant les synthétiser, doivent les trouver dans leur alimentation.
Encyclopédie Universelle. 2012.
